Залаин крем при молочнице у женщин
Статьи
Н.М.Подзолкова, Т.И.Никитина, И.А.Вакатова
Кафедра акушерства и гинекологии Российской медицинской академии последипломного образования, Москва
Вульвовагиниты, обусловленные грибковой инфекцией, составляют 24-36% в структуре инфекционных заболеваний вульвы и влагалища [1].
Большое значение в возникновении и росте частоты случаев вульвовагинального кандидоза имеет ряд предрасполагающих факторов, таких как длительный, нередко бесконтрольный прием антибиотиков, терапия кортикостероидами, цитостатиками, использование оральных контрацептивов, наличие тяжелых инфекционных заболеваний, эндокринных нарушений, иммунодефицитных состояний и др. Кроме того, развитию вульвовагинального кандидоза могут способствовать современные “блага” цивилизации, к каким можно отнести ношение тесного синтетического белья, плотно облегающего тело и создающего микроклимат с повышенной влажностью и температурой [2], что способствует снижению защитных возможностей нормальной микрофлоры влагалища, возникновению дисбактериоза, который усиливает размножение и патогенность грибов.
В настоящее время вульвовагинальный кандидоз подразделяют на следующие клинические формы:
- кандидоносительство (отсутствие клинических проявлений заболевания, дрожжеподобные грибы выявляются в низком титре – менее 104 КОЕ/мл, а в составе микробных ассоциантов вагинального микроценоза абсолютно доминируют лактобациллы в количестве 6-8 lg КОЕ/мл);
- острый вульвовагинальный кандидоз (ярко выраженные воспалительные изменения слизистых оболочек, сопровождающиеся обильными характерными творожистыми белями, при длительности заболевания не более 2 мес). При этом в случае истинного кандидоза в вагинальном микроценозе в высоком титре присутствуют грибы Candida (более 104 КОЕ/мл) наряду с высоким титром лактобацилл (более 106 КОЕ/мл) при отсутствии диагностически значимых титров каких-либо других условно-патогенных микроорганизмов. В случае сочетания вагинального кандидоза и бактериального вагиноза дрожжеподобные грибы участвуют в полимикробных ассоциациях с облигатно-анаэробными бактериями и гарднереллами, при резком снижении концентрации или отсутствии лактобацилл.
- хронический рецидивирующий вульвовагинальный кандидоз (характеризуется длительностью заболевания более 2 мес, когда в течение года регистрируется 4 клинически выраженных эпизода и более). Хроническому вульвовагинальному кандидозу присущи слабая гиперемия и инфильтрация слизистых оболочек, скудные беловатые пленки в виде вкраплений и островков, сухие без четких границ эрозии, лихенизации, экскориации, трещины, атрофичность тканей. Изменения наружных половых органов иногда могут напоминать крауроз.
Следует учитывать, что кандидоносительство в определенных условиях может переходить в клинически очерченную форму. Нередко заболевание приобретает упорное, хроническое и рецидивирующее течение, резистентное к проводимой терапии. Это объясняется глубоким проникновением грибов в клетки многослойного эпителия и образование фагосом, в которых морфологически не измененная кандида может персистировать длительное время и даже размножаться, будучи защищенной от действия лекарственных средств. В последние десятилетия выявляется определенная закономерность к повышению носительства грибов рода кандида, увеличивается частота развития кандидоза у беременных женщин, что в свою очередь повышает угрозу внутриутробного (интранатального и антенатального) инфицирования плода и постнатального инфицирования новорожденных. По данным различных авторов, за последние 20 лет частота кандидоза среди доношенных новорожденных возросла с 1,9 до 15% (Г.А.Самсыгина и соавт., 1996; Е.В.Пронина, 1996), а кандидозные вульвовагиниты во время беременности в 35 раз чаще приводят к колонизации микроорганизмами в ротовой полости детей, чем при их отсутствии. Особенностью данной инфекции является возможность распространения на другие органы и системы с развитием генерализованных форм кандидоза.
Несмотря на сохранение ведущей роли в этиологии кандидоза C. albicans (85-90%), за последние 10 лет распространенность вульвовагинального кандидоза, вызванного прочими видами Candida (C. glabrata, C. tropicalis, C. guillermondi, C. parapsilosis, C. krusei, C. pseudotropicalis и др.), увеличилась почти вдвое [3]. В настоящее время кандидоз, обусловленный видами Candida, отличными от C. albicans, многие авторы выделяют особо как не-albicans-кандидоз, подчеркивая значение проблемы [4].
Наряду с моноинфекцией вульвовагинальный кандидоз может сочетаться с другой инфекционной патологией. За последнее время значительно увеличилась частота смешанных вульвовагинитов. По данным литературы, 80% больных обращаются в женскую консультацию с симптомами вульвовагинита, имеющего смешанную бактериально-грибково-трихомонадную этиологию, что осложняет диагностику и течение заболевания.
Терапия вульвовагинального кандидоза представляет достаточно трудную задачу и зависит от клинической формы заболевания, состояния макроорганизма. Основной целью лечения является прежде всего эрадикация возбудителя инфекции при отсутствии отрицательного воздействия препаратов на организм человека. Принципы терапии различных клинических форм заболевания имеют существенные различия в способе введения лекарственных веществ, дозировке и продолжительности лечения. В соответствии с классификацией Л.С.Страчунского и соавт. [5] для лечения вульвовагинального кандидоза в настоящее время используют следующие основные антимикотические препараты:
- полиенового ряда (натамицин, нистатин, леворин, амфотерицин В);
- имидазолового ряда (клотримазол, кетоконазол, омоконазол, миконазол, бифоназол, гинезол и др.);
- триазолового ряда (флуконазол, итраконазол);
- прочие препараты (гризеофульвин, флуцитозин, нитрофунгин, декамин, препараты йода и др.).
Различают следующие пути введения противогрибковых средств:
- системный (пероральный, внутривенный и др.);
- местный (вагинальные суппозитории, таблетки и глобули, кремы, растворы).
Для лечения острых форм заболевания обычно бывает достаточно применения антимикотических средств местного действия. При выраженных клинических симптомах заболевания и хронических формах вульвовагинального кандидоза наиболее целесообразна комбинированная терапия антимикотиками системного и местного действия.
Несмотря на то что в настоящее время акушеры-гинекологи имеют в своем арсенале широкий спектр различных антимикотических препаратов, четкая тенденция увеличения числа заболеваемости кандидозной инфекцией служит поводом для поиска новых методов лечения и новых эффективных фармакологических препаратов. На сегодняшний день существует потребность в фармакологических средствах с отличным от других механизмом действия, оказывающих не только фунгистатический эффект, как подавляющее большинство противогрибковых средств (зачастую приводящий к развитию устойчивости различного характера), но и фунгицидный.
Оправдан поиск антимикотиков с максимально широким спектром действия, воздействующим на все виды грибов рода Candida и другие патогенные дрожжевые грибы: Torulopsis, Trichosporon, Malassezia (Pityrosporym orbiculare), дерматофиты Trichophyton, Microsporum, Epidermophiton, филаментные грибы-оппортунисты Scopulariopsis, Altermania, Acremonium, Aspergillus, Fusarium, грамотрицательные и грамположительные микроорганизмы, включая анаэробные, а также простейшие, особенно рода Trichomonas. Такой широкий спектр воздействия необходим, так как в последнее время значительно увеличилась частота смешанных вульвовагинитов, а также кандидозных вульвовагинитов, протекающих в виде стертых и атипических форм заболевания, обусловленных не-albicans-этиологией и грибами других родов [1].
Необходимо отметить новый антимикотик сертаконазол, представляющего собой производное бензотиофена и имидазола, выпускаемый в виде вагинальных суппозиториев. По механизму действия сертаконазол оказывает не только фунгистатическое, но и фунгицидное воздействие на возбудителя.
Двойной механизм действия обусловлен наличием в структуре традиционного для имидазолов азолового кольца и принципиально нового соединения – бензотиофена.
Азоловая структура препятствует синтезу эргостерина (эргостерол), одного из основных компонентов мембраны грибковой клетки, обусловливая тем самым фунгистатический эффект. Непосредственной мишенью для действия азолов является фермент С-14a-деметилаза ланостерола, участвующий в синтезе эргостерола (ему соответствует холестерин человека). Для того чтобы ингибиторы эргостеролового синтеза оказывали свое действие, необходимо их проникновение внутрь грибковой клетки, накопление в достаточной концентрации, перемещение к микросомам, на которых расположен фермент-мишень и связь с этим ферментом. Соответственно в развитии устойчивости могут быть задействованы механизмы снижения концентрации препарата в клетке за счет сокращения его поступления или, наоборот, усиленного выведения из клетки, разрушение или химическая модификация препарата на его пути к мишени, нарушенное взаимодействие с мишенью за счет ее видоизменения или исчезновения. Кроме того, существуют адаптационные механизмы, при которых количество ферментов-мишеней возрастает до такой степени, что препарата для связи с ними не хватает, а также запасные пути метаболизма [4].
С учетом всех описанных механизмов в состав сертаконазола был введен принципиально новый компонент – бензотиофен, который провоцирует разрыв плазматической мембраны грибковой клетки, что и приводит к ее гибели, т.е. оказывает фунгицидное действие. Бензотиофен обладает высокой липофильностью, чем усиливает проникновение сертаконазола в кожу и ее придатки. Благодаря такому двойному механизму действия риск развития рецидивов является минимальным.
Цель исследования: оценить клиническую эффективность сертаконазола в лечении острого вульвовагинального кандидоза у небеременных и некормящих женщин.
Материалы и методы
Под наблюдением находились 45 женщин в возрасте от 17 до 48 лет (средний возраст составил 27,8 года), обратившихся по поводу острого вульвовагинального кандидоза.
Клинический диагноз подтвержден микроскопическим исследованием и культивированием на питательных средах фирм “БиоРад” и “БиоМерье”.
В посевах определен рост грибов рода Candida и неспецифической флоры (Streptococcus spp., Stahpillococcus spp., Proteus spp., Bacteroides spp., E. сoli и др.). Диагноз острого вульвовагинального кан-дидоза устанавливали на основании наличия клинических проявлений и обнаружения в вагинальном отделяемом более 104 КОЕ/мл.
Критериями исключения являлись: беременность и лактация, отсутствие надежных средств контрацепции, наличие других инфекций влагалища, таких как гонорея, микоплазмоз, уреаплазмоз, хламидиоз, вирусные инфекции (исключение проводилось методом полимеразной цепной реакции), а также применение других противогрибковых препаратов и местных влагалищных средств в течение последнего месяца.
После установления диагноза все пациентки получали местную монотерапию 1-дневным курсом препарата «Залаин» (сертаконазол): по 1 свече (300 мг) глубоко в задний свод влагалища на ночь. Через 1 нед после лечения пациенткам проводили повторное микроскопическое и культуральное исследование. При отсутствии клинического и микологического излечения назначали повторное 1-кратное введение 300 мг препарата в задний свод влагалища с повторным контролем через 7 дней. Таким образом, каждой пациентке проводилось 3-кратное контрольное исследование через 7, 14 и 28-30 дней. При каждом визите больной проводили анкетирование с целью выявления возможных нежелательных эффектов. Половой партнер пациентки при наличии у него сходных жалоб получал соответствующее лечение кремом, содержащим сертаконазол, с рекомендациями использовать презерватив для предотвращения реинфекции.
Результаты и обсуждение
Симптомы, отмеченные при каждом клиническом обследовании, включали гиперемию, отек, обильные или умеренные творожистые выделения из половых путей, высыпания в виде везикул на коже и слизистых оболочках вульвы и влагалища. Оценку основных жалоб и клинических симптомов проводили по 3-балльной шкале: 0 баллов – отсутствие симптомов, 1 балл – легкая степень выраженности, 2 балла – умеренные проявления и 3 балла – тяжелая степень заболевания.
При первичном обследовании практически у всех 45 (100%) больных отмечены жалобы на обильные или умеренные бели, которые у 30 женщин (66,7%) оценены 2 баллами, 15 (33,3%) женщин отмечали выраженные выделения, соответствующие 3 баллам. Умеренные зуд, жжение, раздражение наружных половых органов (2 балла) отметила 21 (46,7%) пациентка, сильные (3 балла) – 24 (53,3%) пациентки.
У всех 45 (100%) пациенток возбудителем вульвовагинального кандидоза являлся вид C. albicans. Кроме того, в посевах определялся рост следующих неспецифических возбудителей: стрептококки группы D у 9 (20%) больных в количестве 103-108 КОЕ/мл; стрептококки группы В у 3 (6,6%) в количестве 105 КОЕ/мл; эпидермальный стафилококк у 6 (13%) в количестве 105 и 103 КОЕ/мл; бактероиды у 12 (26%) в количестве 103-104 КОЕ/мл; протей у 3 (6,6%) в количестве 104 КОЕ/мл; кишечная палочка у 3 больных (6,6%) в количестве 105 КОЕ/мл.
Диапазон продолжительности заболевания составил от 1 до 5 нед. Средняя продолжительность заболевания составила 2,3 нед.
У каждой третьей женщины манифестация заболевания была связана с приемом антибиотиков по тем или иным показаниям, у 12 (26,7%) женщин вульвовагинальный кандидоз возник на фоне приема гормональных контрацептивов. В анамнезе у 24 (53,3%) больных отмечены перенесенные инфекции, передаваемые половым путем: хламидиоз у 3 (6,6%), трихомоноз у 6 (13%), уреаплазмоз у 12 (26%), микоплазмоз у 9 (20%), бактериальный вагиноз у 9 (20%), гонорея у 3 (6,6%).
У 27 (60%) больных ранее уже отмечены эпизоды острого вульвовагинального кандидоза, у 12 (26,7%) из них – неоднократно, по поводу которых женщины принимали курсы различных антимико-тических средств местного действия: натамицин – 6 (22,2%), кетоконазол – 3 (11,1%), клотримазол – 15 (55,5%), миконазол – 3 (11,1%), эконазол – 6 (22,2%), нистатин в свечах – 6 (22,2%). Регулярный менструальный цикл имели 36 (80%) женщин. Дисфункцией яичников репродуктивного периода страдали 6 (13%), у 3 (6,7%) пациенток в анамнезе имела место надвлагалищная ампутация матки без придатков по поводу множественной миомы матки. У 15 (33,3%) женщин в анамнезе были одни роды и более. Тяжелых экстрагенитальных и инфекционных заболеваний у обследованных больных не было.
При кольпоскопии у 33 (73,3%) больных выявлены изменения, характерные для воспалительного процесса: выраженный сосудистый рисунок, после нанесения раствора Люголя – йодоперистая картина диффузного кольпита.
Клинические исследования показали, что 36 (80%) пациенток отметили исчезновение или значительное уменьшение симптомов заболевания уже на следующий день после применения препарата. Слабовыраженный зуд во влагалище (1 балл) и умеренные бели (2 балла) беспокоили лишь 9 (20%) женщин. Слабые клинические проявления вульвовагинального кандидоза (1 балл) через 7 дней при контрольном осмотре беспокоили 6 (13%) женщин, что потребовало назначения повторного курса терапии.
Побочных эффектов и аллергических реакций при применении залаина не отмечено ни у одной женщины.
При микроскопическом и культуральном исследовании отделяемого из влагалища через 7 дней у 39 (87%) и через 14 дней у 6 (13%) женщин, получивших повторную терапию, после проведенного лечения дрожжеподобные грибы в незначительных количествах обнаружены лишь у 1 (2,2%) пациентки. Рост неспецифических возбудителей при повторных обследованиях не был выявлен. Клинических проявлений вульвовагинального кандидоза не наблюдали ни у одной из пациенток (см. рисунок).
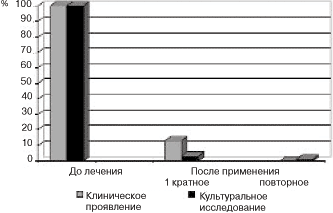 |
Динамика клинических симптомов заболевания и микологической санации под влиянием сертаконазола. |
При очередном контрольном обследовании через 1 мес после проведенного лечения у всех пациенток наблюдали полное клиническое излечение и только у 1 (2,2%) женщины при культуральном исследовании обнаружены дрожжеподобные грибы в клинически незначимом количестве 5 на 102 КОЕ/мл, что было расценено как бессимптомное кандидоносительство. Неспецифическая флора не выявлена ни у одной из женщин.
Полного клинического излечения и микологической санации при однократном интравагинальном введении 300 мг сертаконазола (1 свеча) на ночь и в случае необходимости при повторном введении через 7 дней мы добились у 97,8% больных женщин.
Выводы
Исследования показали, что сертаконазол, производное имидазола и бензотиофена, является эффективным и безопасным средством для лечения острого вульвовагинального кандидоза. Кроме выраженного антимикотического эффекта сертаконазол обладает широким спектром действия (в том числе действует и на неспецифическую флору: Streptococcus spp., Stahpillococcus spp., Proteus spp., Bacteroides spp., E. сoli). Высокая клиническая эффективность сертаконазола (97,8%), короткий курс лечения, удобство применения, отсутствие каких-либо побочных эффектов и системного воздействия, широкий спектр действия позволяют считать этот препарат наиболее перспективным в лечении острого вульвовагинального кандидоза, в том числе в сочетании с неспецифическим вагинитом, у небеременных и не-кормящих женщин.
Литература
- Прилепская В.Н., Байрамова Г.П. Вагинальный кандидоз: этиология, клиника, диагностика, принципы терапии. Контрацепция и здоровье. 2002; 1: 3-8.
- Минкина Г.Н. Лечение острого кандидозного вульвовагинита. Гинекология. 2001; 3 (6): 208-9.
- Краснопольский В.И., Серова О.Ф. Клиническая эффективность орунгала при хроническом вагинальном кандидозе. Рос. вестн. акушера-гинеколога. 2003; 1: 30-32.
- Сергеев А.Ю., Маликов В.Е., Жариков Н.Е. Этиология вагинального кандидоза и проблема устойчивости к антимикотикам. Национальная академия микологии, серия “Медицинская микология”. 2001; вып. 4.
- Страчунский Л.С., Белоусов Ю.Б., Козлова С.Н. Антибактериальная терапия. Практическое руководство. М., 2000.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Внедрение в клиническую микробиологию современных методов исследования позволило существенно расширить наши представления об отрицательном воздействии факторов внешней среды на микрофлору макроорганизма, что ведет к развитию разнообразных патологических процессов как воспалительного, так и невоспалительного генеза.
Речь, в частности, идет о дисбактериозе влагалища. Несмотря на появление новых методов диагностики, терапии и профилактики этого состояния, частота дисбактериоза влагалища продолжает оставаться высокой, что влияет на здоровье и психоэмоциональную сферу огромного числа женщин [1-4]. Одной из основных причин развития данного состояния является рост числа иммунодефицитных состояний, наблюдаемый на фоне ухудшения экологической обстановки, неправильного питания, частых стрессов, фармакологического бума с бесконтрольным применением лекарственных средств, в первую очередь антибиотиков [5].
Чаще всего генитальная инфекция, вызывающая дисбактериоз влагалища, обусловлена несколькими патогенными факторами – вирусами, бактериями, грибами, простейшими, которые вызывают схожие по клиническому течению, но различные по патогенезу и методам лечения заболевания [1, 6, 7].
Вульвовагинальный кандидоз является превалирующим инфекционным заболеванием, поражающим слизистую вульвы и влагалища у женщин репродуктивного возраста. В последние годы распространенность кандидоза неуклонно растет, удельный вес этого заболевания в структуре инфекционных поражений вульвы и влагалища составляет 30-45%. Вульвовагинальный кандидоз занимает второе место среди всех инфекций влагалища и является одной из наиболее распространенных причин обращения женщин к гинекологу. В США и Европе ежегодно регистрируется 13 млн случаев этого заболевания [8, 9].
Этиология
Анализ медицинской литературы последних лет свидетельствует о возросшем интересе к проблеме микозов в целом и вульвовагинального кандидоза в частности. Микозы – широко распространенная группа инфекций, которые вызываются большим числом различных видов патогенных и условно-патогенных грибов [3, 10-13].
Грибы’ (лат. Fungi или Mycota) – царство живой природы, объединяющее эукариотические организмы, сочетающие в себе некоторые признаки как растений, так и животных.
Микозы являются важной проблемой клинической медицины. Из потенциальных «болезней будущего» микозы превратились в актуальные «болезни настоящего». Возбудители микозов многочисленны, и вызываемые ими заболевания человека и животных весьма разнообразны. Количество видов микроскопических грибов (микромицетов) оценивается примерно в 100 000-200 000 видов. Ежегодно описывается приблизительно 1500 новых видов. Реальное значение в клинической практике в настоящее время имеют около 100 видов [14].
Дрожжеподобные грибы рода Candida принадлежат к семейству Cryptococcaceae. В настоящее время известно до 200 видов грибов рода Candida. Из них лишь C. albicans, С. glabrata, C. pseudotropicalis, C. tropicalis, C. krusei, C. parapsilosis, C. quillermondii и некоторые другие могут вызвать заболевания. Candida spp. – одноклеточные дрожжевые микроорганизмы размером 6-10 мкм.
Многие Candida spp. диморфны, образуют псевдомицелий или мицелий. Повсеместно некоторые Candida spp. выявляют при посевах со слизистой оболочки полости рта и ЖКТ у 30-50% здоровых людей, со слизистой оболочки гениталий – у 20-30% здоровых женщин. Поэтому важно различать заболевание (кандидоз) и колонизацию слизистых оболочек или кожи, при которой применения антимикотиков обычно не требуется.
Источник возбудителя инвазивного кандидоза обычно эндогенный, поскольку Candida spp. – естественные обитатели слизистых оболочек и кожи человека [15].
Основная роль в возникновении вагинального кандидоза принадлежит грибам рода Candida albicans, которые выделяются в 95% случаев этого заболевания. Они являются наиболее патогенными вследствие высокой адгезивной способности и выработки литических ферментов, обеспечивающих их пенетрацию в эпителиоциты влагалища [16].
Факторами риска развития вагинального кандидоза являются:
- длительный и/или бессистемный прием антибиотиков [17];
- беременность;
- использование оральных контрацептивов (особенно с высоким содержанием эстрогенов);
- применение кортикостероидов, цитостатиков, лучевой терапии;
- эндокринные заболевания (сахарный диабет, дисфункция яичников);
- развитие иммунодефицита (тяжелые инфекционные заболевания, травмы, операции).
Предрасполагающими к развитию заболевания факторами могут быть:
- ношение синтетической облегающей одежды;
- ожирение;
- несоблюдение гигиенических условий;
- жаркий климат;
- использование гигиенических средств;
- употребление йогуртов и продуктов с повышенным содержанием лактобацилл [18].
В то же время подчеркивается противоречивость полученных данных в отношении перечисленных факторов риска развития вульвовагинального кандидоза, что обусловливает необходимость проведения дополнительных исследований [19].
Особенности инфекции
В развитии кандидозной инфекции различают следующие этапы:
1. Адгезия грибов к поверхности и колонизация грибами слизистой оболочки.
2. Инвазия в эпителий, преодоление эпителиального барьера слизистой оболочки, попадание в соединительную ткань собственной пластинки, преодоление тканевых и клеточных защитных механизмов.
3. Проникновение в сосуды и гематогенная диссеминация с поражением различных органов и систем.
Значительное увеличение числа случаев вульвовагинального кандидоза обусловлено действием предрасполагающих факторов, описанных выше. При назначении антибиотиков широкого спектра действия необходимо учитывать, что они подавляют не только патогенные бактерии, но и находящиеся во влагалище лактобациллы, являющиеся физиологическими антагонистами дрожжеподобных грибов (лактобациллы подавляют прикрепление Candida к клеткам эпителия и их размножение). В результате сдвига рН в щелочную среду влагалищного содержимого процесс самоочищения влагалища нарушается. Кроме того, Candida обладают способностью использовать антибиотики в качестве источников питания. При этом создаются благоприятные условия для активного размножения Candida в половых органах женщины [20].
Принято различать 3 клинические формы вагинального кандидоза:
- кандидоносительство;
- острая форма вульвовагинального кандидоза;
- хронический (рецидивирующий) вульвовагинальный кандидоз.
Кандидоносительство характеризуется отсутствием симптомов заболевания, но в микробиологическом исследовании в отделяемом влагалища дрожжеподобные грибы рода Candida присутствуют в небольшом количестве (<104 КОЕ/мл). Бессимптомное носительство Candida отмечается у 15-20% небеременных женщин репродуктивного возраста.
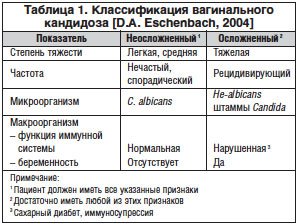
Терминология острого и хронического вульвовагинального кандидоза, подразумевающая только частоту рецидивов, упрощает постановку диагноза, но в то же время выделение в классификацию осложненной и неосложненной форм заболевания подразумевает вид возбудителя, тяжесть течения заболевания, а также состояние макроорганизма, что влияет на выбор способа терапии [20].

По мнению ряда авторов, причинами рецидивирующего вульвовагинального кандидоза являются изменения в локальном и клеточном иммунитете на уровне слизистой оболочки влагалища. Меньшее значение имеет гуморальный и врожденный иммунитет. Т1- и Т2-опосредованные клеточные реакции коррелируют с резистентностью и предрасположенностью к кандидозу слизистых оболочек. Реактивность Т1-типа с продукцией ИЛ-2, ИЛN-g и ИЛ-12 (стимулирующие макрофаги и полиморфно-ядерные лимфоциты), а также IgА слизистой оболочки являются доминирующими реакциями во влагалище. Они поддерживают бессимптомную колонизацию Candida. Реактивность Т2-типа с образованием ИЛ-4-6, ИЛ-10, IgG, гистамина и простагландина Е2 преобладает в тех случаях, когда эндогенные и экзогенные факторы приводят к увеличению числа микроорганизмов C. albicans. Этот ответ «выключает» защитные реакции Т1-типа и запускает реакции гиперчувствительности немедленного типа. Candida из фазы бластоспоры переходит в фазу гифы и возникает инвазия эпителия [21].
В настоящее время наиболее современная классификация вагинального кандидоза предложена D. A. Eschenbach (табл. 1) [22].
Одной из основных особенностей течения вульвовагинального кандидоза является его частое сочетание с условно-патогенной бактериальной микрофлорой, обладающей высокой ферментативной и литической активностью, что создает благоприятные условия для внедрения грибов в ткани [23].
Клиническими проявлениями вульвовагинального кандидоза являются: интенсивно выраженное раздражение и зуд во влагалища; типичные белые творожистые выделения и жжение в области наружных половых органов при мочеиспускании и болезненность при половом акте.
При хроническом рецидивирующем заболевании часто наблюдают обострение перед началом менструации [24].
Диагностика острого вульвовагинального кандидоза не представляет сложностей – это микроскопия патологического материала (соскобы со слизистых оболочек пораженных участков) и обнаружение в нативных или окрашенных по Граму препаратах дрожжевых почкующихся клеток и/или псевдомицелия и мицелия Candida spp. Во всех случаях необходимо исключить инфекции, передаваемые половым путем. Можно использовать рН-исследование. Если при цитологическом методе исследования Candida spp. не обнаружены (чувствительность метода составляет 65-70%), при наличии характерных клинических проявлений следует выполнить культуральное исследование (посев материала на специализированные среды) с целью обнаружения колоний Candida spp. В случае острого кандидоза указанных диагностических мероприятий вполне достаточно для постановки этиологического диагноза. При хроническом рецидивирующем вульвовагинальном кандидозе необходимы видовая идентификация возбудителя (при этой форме заболевания частота обнаружения грибов Candida, не относящихся к виду С. albicans, составляет до 20-25%) и определение чувствительности выделенной культуры грибов к антимикотическим препаратам [25-28].
Также можно использовать молекулярно-биологические методы исследования (полимеразная цепная реакция) – выявление ДНК определенного вида дрожжеподобных грибов, серологические реакции – реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция преципитации, реакция пассивной гемагглютинации. Из комплекса серологических исследований наиболее существенное значение имеет РСК с дрожжевыми антигенами (1:10, 1:16). Диагностическим титром РА при кандидозах считается разведение сыворотки более чем 1:100 и иммуноферментный анализ – определение IgE-антител против C. albicans во влагалищных смывах. Наиболее высоким является титр IgE-антител к серотипу, А, который составляет 83% всех штаммов C. аlbicans [29].
Около 20-25% женщин с отрицательным результатом бактериологического исследования имеют положительные результаты посева на Candida уже через 30 дней после лечения. Это означает, что незначительное число микроорганизмов остается персистировать во влагалище, причем этого количества недостаточно для возникновения симптомного вагинита, но достаточно для того, чтобы при воздействии перечисленных триггерных факторов, стимулирующих избыточный рост грибов, привести к рецидиву заболевания [30].
Установлена прямая связь между сроком гестации и частотой возникновения вагинального кандидоза, для которого во время беременности характерны бессимптомное течение и частые рецидивы. Если грибы рода Candida обнаруживаются во влагалище 10-17% небеременных женщин, то вагинальный кандидоз у беременных встречается, по различным данным, в 30-40% случаев, достигая перед родами 44,4% [31]. Такие высокие показатели обусловлены изменениями гормонального баланса во время беременности [8].
Лечение
Современная фармакология предоставляет большой выбор препаратов антимикотического действия, но вопрос эффективности лечения на сегодняшний день остается до конца не решенными и не теряет своей актуальности. Требуется доработка старых и разработка новых схем лечения вульвовагинального кандидоза.
Терапия зависит от клинической формы заболевания. Основной целью назначения препаратов, обладающих адекватным спектром действия, является одновременное воздействие непосредственно на возбудителя и возможные системные резервуары дрожжеподобных грибов для эрадикации возбудителя и исключения возможных рецидивов [20].
Улучшению терапии вульвовагинального кандидоза способствуют сексуальное воздержание, объяснение врачом природы инфекции и способов лечения, понимание пациенткой, что исчезновению симптомов заболевания должна сопутствовать микробиологическая санация [32].
Для лечения вульвовагинального кандидоза в настоящее время используют следующие основные антимикотические препараты:
- полиенового ряда (натамицин, нистатин, леворин, амфотерицин В);
- имидазолового ряда (клотримазол, кетоконазол, омоконазол, миконазол, бифоназол и др.);
- триазолового ряда (флуконазол, итраконазол);
- прочие препараты (гризеофульвин, флуцитозин, хлорнитрофенол, деквалиния хлорид, препараты йода и др.).
Различают следующие пути введения противогрибковых средств:
- системный (пероральный, внутривенный и др.);
- местный (вагинальные суппозитории, таблетки и глобули, кремы, растворы) [33].

Впервые зарегистрированный в России сертаконазол (рис. 1) в виде вагинальных суппозиториев с длительным высвобождением препарата, содержащих 300 мг активного вещества, произведен Laboratoires Théramex (Монако) и маркетируется на российском рынке по лицензии фирмы Ferrer Internacionale A.S. (Испания) венгерским фармацевтическим заводом EGIS под торговым названием Залаин (Zalain). Залаин является противогрибковым средством – производным бензотиофена и имидазола – для местного использования.
Залаин вызывает лизис клеток грибов. Также механизм действия данного препарата связан с конкурентным антагонизмом с другим компонентом оболочки клеток – триптофаном. В терапевтических дозах препарат обладает фунгицидным и фунгистатическим действием. При интравагинальном введении высокие уровни Залаина сохраняются во влагалище продолжительное время и значительно превышают и минимальные ингибирующие, и фунгицидные концентрации против C. albicans, C. glabrata и прочих грибов, которые не относятся к роду Candida. Системное всасывание отсутствует при интравагинальном использовании. Залаин в неизмененном виде не обнаруживается ни в моче, ни в плазме крови.
В состав Залаина введен принципиально новый компонент – бензотиофен, который провоцирует разрыв плазматической мембраны клетки гриба, что и приводит к ее гибели, т. е. обеспечивается фунгицидное действие препарата. Бензотиофен обладает высокой липофильностью, чем усиливает проникновение препарата в кожу и ее придатки. Благодаря такому двойному механизму действия риск развития рецидивов является минимальным. Побочных эффектов и аллергических реакций при применении Залаина не отмечено ни у одной женщины.
Проведенные исследования показали, что Залаин – производное имидазола и бензотиофена, является эффективным и безопасным средством для лечения острого вульвовагинального кандидоза. Кроме выраженного антимикотического эффекта препарат обладает широким спектром действия (в т. ч. влияет и на неспецифическую флору: Streptococcus spp., Staphylococcus spp., Proteus spp., Bacteroides spp., E. сoli). Высокая клиническая эффективность Залаина (97,8%), короткий курс лечения, удобство применения, низкая частота побочных эффектов, незначимое системное воздействие, широкий спектр действия позволяют считать этот препарат перспективным в лечении острого вульвовагинального кандидоза, в т. ч. в сочетании с неспецифическим вагинитом, у небеременных и некормящих женщин [33].
При исследовании штаммов грибов, выделенных из влагалищного содержимого, были проведены тесты на чувствительность к различным азолам, нистатину, амфотерицину B и флуцитозину. Оказалось, что чувствительность к Залаину превосходила таковую к другим антимикотикам, свидетельствуя о большей активности Залаина [35].
Учитывая, что беременность является основным предрасполагающим фактором для развития вульвовагинального кандидоза, особую проблему представляет его лечение при данном состоянии [36].
К препаратам, применяемым у беременных, предъявляют особые требования. Наряду с высокой эффективностью и минимальной способностью индуцировать развитие резистентности у возбудителей, они должны характеризоваться низкой эмбриотоксичностью и хорошей переносимостью для матери. Некоторые противогрибковые препараты противопоказаны при беременности в связи с наличием у них тератогенного эффекта. С целью снижения риска развития нежелательных системных эффектов у матери и плода наиболее безопасным в период беременности является интравагинальный путь введения антимикотиков. Кроме того, при таком способе введения быстрее наступают редукция клинической симптоматики и выздоровление [12].
В связи с этим проведено исследование, в котором было выявлено, что Залаин высокоэффективен при однократном режиме лечения у беременных женщин. При этом его переносимость и удобство в применении позволяют считать данный препарат одним из перспективных в антифунгальной терапии острого вульвовагинального кандидоза у женщин во время беременности [37].
В заключение можно сказать, что Залаин можно использовать для лечения как острой формы вульвовагинального кандидоза, так и рецидивирующей, а также у беременных женщин.
Источник
