Рецидив после операции простатита
29 октября 2020
Даже после тщательно проведённой операции по поводу злокачественной опухоли простаты есть риск возврата болезни. Раковые клетки могут остаться в сопредельных с железой тканях, шейке мочевого пузыря, прямой кишке. Последующая лучевая или химиотерапия не всегда даёт эффект. Причиной неэффективности лечения рака простаты часто оказывается позднее обращение за помощью.
При I–II стадии рака и своевременном лечении возможно полное излечение, когда аденокарцинома достигла III–IV степени, высок риск рецидива.
Степень риска зависит:
- от размеров опухоли, её прорастания в окружающие ткани;
- возраста и общего состояния здоровья пациента;
- уровня простатического антигена до и после операции;
- суммы баллов по Глисону.
После лапароскопической радикальной простатэктомии удалённые ткани отправляют на гистологическое исследование. Результаты оценивают по шкале Глисона: чем больше найдено мутировавших, низкодифференцированных клеток, тем хуже прогноз.
Рецидив бывает биохимическим, местным и системным.
Важный маркер возвращения опухоли — повышение в крови ПСА.
Биохимический рецидив после радикальной простатэктомии
В течение первых пяти лет встречается у 15–42% пациентов. Физических симптомов рака простаты ещё нет. Человек чувствует себя хорошо, но внезапно появляется рост показателя ПСА выше 0,2 нг/мл по двум последним анализам крови. Врачи проводят дополнительное обследование, делают анализы крови и мочи, УЗИ, МРТ, при необходимости — остеосцинтиграфию и биопсию. По результатам выбирают способы лечения.
Местный рецидив после простатэктомии
Когда повышение специфического антигена не замечено вовремя и не приняты меры, на месте удалённой предстательной железы вырастает новая опухоль. Метастазов ещё нет. Если образование не выходит за пределы своей капсулы и сумма баллов по Глисону меньше 7, прогноз лечения благоприятный. Прорастание опухоли за пределы капсулы ухудшает шансы на желательный исход. Когда распространение обширное, захватывает семенные пузырьки, врачи предполагают плохой прогноз. На этом этапе появляются боли внизу живота, проблемы с мочеиспусканием и потенцией.
Системный рецидив после радикальной простатэктомии
О таком виде рецидива рака предстательной железы говорят, когда обнаружены метастазы в лимфоузлах и других органах: позвоночник, печень, головной мозг, лёгкие. Самочувствие больного ухудшают общая слабость, боли и нарушение функции поражённых метастазами органов.
Лечение рецидивов
Для уничтожения опухолевых клеток применяют:
- Химиотерапию.
- Облучение места опухоли.
- Ультразвуковую абляцию поражённых тканей.
- Гормональное лечение для снижения уровня специфического антигена и тестостерона при системном распространении опухоли.
На всех этапах проводят симптоматическую терапию для облегчения боли, улучшения самочувствия, устранения нарушений мочеиспускания.
Избежать рецидива рака предстательной железы после радикальной простатэктомии можно при чётком соблюдении рекомендаций уролога и контроле ПСА. Врачи Клиники урологии имени Р. М. Фронштейна помогут наладить онкологическое наблюдение и график обследований. Запишитесь на консультацию по телефону +7 (499) 409-12-45.
29 октября 2020
Акопян Гагик Нерсесович – врач уролог, онколог, д.м.н., врач высшей категории, профессор кафедры урологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова
Все публикации…
Источник
Лечение рецидива рака простаты
Лечение рецидива рака простаты после радикальной простатэктомии
Сроки и тактика лечения при подъёме уровня ПСА после простатэктомии или лучевой терапии вызывают дискуссии. В случае рецидива после операции возможны наблюдение, облучение ложа опухоли, HIFU-терапия рецидива, гормонотерапия рака простаты (в том числе комбинированная, периодическая или сочетанное применение финастерида и антиандрогенов), а также сочетание гормоно- и химиотерапии. Эти методы применимы и при рецидиве после лучевой терапии.
Гормонотерапия
При высоком дооперационном уровне ПСА (более 20 нг/м, индексе Глисона более 7, нерадикальной операции и местнораспространённых опухолях рТ3b, рТxN1) целесообразна ранняя гормонотерапия. Однако ее влияние на выживаемость до сих пор не установлено. При ранней гормонотерапии метастазы возникают реже, чем при отсроченной, выживаемость в обоих случаях примерно одинаковая. Необходимость гормонотерапии подтверждает испытание МRС, в котором рецидив был отмечен у всех больных, получивших лучевую терапию по поводу роста уровня ПСА после простатэктомии при опухолях рТ3b, рТхN1, и индексе Глисона 8.
Монотерапию антиандрогенными препаратами больные переносят лучше, чем комбинированную (реже возникают приливы, снижение потенции, утрата полового влечения), однако антиандрогены вызывают гинекомастию и боль в сосках. У больных без отдалённых метастазов бикалутамид (по 150 мг/сут) достоверно снижает риск прогрессирования заболевания. Таким образом, антиандрогены могут быть альтернативой кастрации при повышении уровня ПСА после радикального лечения (особенно у относительно молодых больных без сопутствующих заболеваний).
Наблюдение при рецидиве рака простаты
Динамическое наблюдение обычно проводят при индексе Глисона менее 7, позднем (через 2 года после операции) повышении уровня ПСА и времени его удвоения более 10 месяцев. В таких случаях медиана времени до возникновения метастазов составляет 8 лет, а медиана времени от возникновения метастазов до наступления летального исхода – ещё 5 лет.
HIFU-терапия
В последнее время появляется всё больше данных о результатах HIFU-терапии местного рецидива после РПЭ. Чаще всего рецидив обнаруживают при ТРУЗИ и подтверждают гистологически (биопсия). Тем не менее HIFU-терапия лить отодвигает сроки назначения гормонотерапии. Точные данные о выживаемости отсутствуют.
Клинические рекомендации по лечению рецидива после простатэктомии
При местном рецидиве и уровне ПСА менее 1,5 нг/мл показана лучевая терапия до СОД 64-66 Гр,
Если больной ослаблен или возражает против облучения, при местном рецидиве возможно динамическое наблюдение
При росте уровня ПСА, указывающем на системный рецидив, показана гормонотерапия, так как она снижает риск метастазирования.
В качестве гормонотерапии можно использовать аналоги гонадолиберина, кастрацию или бикалутамид (по 150 мг/сут).
Лечение рецидива после лучевой терапии
Наиболее часто больные с рецидивом после лучевой терапии получают гормонотерапию (до 92%). Без лечения время от повышения уровня ПСА до манифестации рецидива составляет около 3 лет. Кроме гормонотерапии при рецидиве после облучения возможно и местное лечение – простатэктомия, HIFU-терапия, криотерапия, брахитерапия. Простатэктомия не нашла широкого применения из-за частых осложнений (недержание мочи, повреждение прямой кишки), а также из-за высокого риска местного рецидива. Однако при тщательном отборе больных эта операция может обеспечить длительный безрецидивный период,
По последним данным. 5-летняя безрецидивная выживаемость после лучевой терапии соответствует таковой после первичной простатэктомии, проведённой на тех же стадиях заболевания, 10-летняя выживаемость составляет 60-66%. В течение 10 лет от прогрессирования опухоли умирают 25-30% больных. При локализованных опухолях, отсутствии опухолевых клеток в крае резекции, инвазии семенных пузырьков и метастазирования в лимфатические узлы безрецидивная выживаемость достигает 70-80% по сравнению с 40-60% при местнораспространённых опухолях.
Простатэктомия при местном рецидиве оправдана при отсутствии тяжелых сопутствующих заболеваний, ожидаемой продолжительности ЖИЗНИ не менее 10 лет, опухолях индексе Глисона менее 7 и уровне ПСА менее 10 нг/мл. В остальных случаях до операции сложно определить распространённость опухоли, что повышает риск передней или тотальной экзентерации, осложнений, а также повторною рецидива.
Рекомендовано динамическое наблюдение за больными с вероятным местным рецидивом (из группы низкого риска, с поздним рецидивом и медленным ростом уровня ПСА), настроенными против повторного радикального лечения. Ретроспективный анализ не обнаружил преимуществ гормонотерапии по сравнению с динамическим наблюдением при времени удвоения уровня ПСА более 12 мес; 5-летняя выживаемость без метастазирования составила 88% при гормонотерапии и 92% – на фоне наблюдения.
Клинические рекомендации по обследованию при подозрении на рецидив рака простаты
После простатэктомии, если уровень ПСА менее 20 нг/мл и скорость его прироста менее 20 нг/мл в год, КТ брюшной полости и малого таза малоинформативна.
Эндоректальная МРТ помогает обнаружить местный рецидив при низком уровне ПСА (1-2 нг/мл). ПЭТ пока не получила широкого распространения.
Сцинтиграфия с мечеными антителами к простатическому мембранному антигену позволяет обнаружить рецилив у 60-80% больных независимо от уровня ПСА.
Биопсию для подтверждения местного рецидива проводят через 18 мес и более после облучения.
[13], [14], [15], [16], [17], [18], [19], [20]
Клинические рекомендации по лечению рецидива после лучевой терапии
У отдельных больных с местным рецидивом возможно выполнение простатэктомии.
При противопоказаниях к операции возможно проведение брахитерапии, HIFU-терапии или криодеструкции.
При вероятном системном рецидиве возможна гормонотерапия рака простаты.
Клинические рекомендации по лечению рецидивов после радикального лечения
Вероятный местный рецидив после простатэктомии | Возможна лучевая терапия в дозе не менее 64 Гр желательно начать её при уровне ПСА менее 1.5 нг/мл. |
Вероятный местный рецидив после лучевой терапии | В отдельных случаях возможна простатэктомия, но больному нужно сообщить о сравнительно высоком риске осложнений. |
Вероятный системный рецидив | Ранняя гормонотерапия замедляет прогрессирование и может увеличить выживаемость по сравнению с отсроченной. Местное лечение проводят только в паллиативных целях. |
[21], [22], [23], [24]
Источник
Радикальная простатэктомия (РПЭ) — самый эффективный метод лечения локализированных форм рака, который позволяет полностью удалить опухоль. Однако даже удаление первичного очага заболевания не исключает появления отдаленных метастазов в послеоперационный период. По имеющимся данным, в России в течение 10 лет после проведения операции у 35 – 40% пациентов с клинически локализованным раком простаты возникает рецидив, при этом у 95% он диагностируется в первые 5 лет после операции.
Причины рецидива рака простаты
Основная причина рецидива рака простаты после радикальной простатэктомии — оставшиеся в организме пораженные клетки, которые в активном состоянии способны к неконтролируемому размножению.
Как в организме остаются злокачественные клетки? В первую очередь, это отдалённые вторичные очаги — метастазы, которые в момент проведения оперативного вмешательства присутствуют в организме. Они распространяются как в ткани ближайших органов (семенные пузырьки, тазовые лимфоузлы, шейку мочевого пузыря, кишечник), так и в печень, легкие, кости осевого скелета, органы центральной нервной системы. Рецидив такого вида называют метастатическим.
После операции по удалению простаты может возникнуть локальный рецидив — при образовании позитивного хирургического края, который представляет собой неиссеченные раковые клетки, оставшиеся после удаления опухоли. Позитивный хирургический край может образоваться, когда рак распространяется за капсулу предстательной железы или при низком качестве оперативного вмешательства.
Факторы прогноза местного рецидива рака простаты после РПЭ
Прогрессирование рака простаты после радикальной простатэктомии происходит крайне медленно и практически бессимптомно. Риск развития рецидива определяют по совокупности биомаркеров: уровню сывороточного ПСА, плотности ПСА патологоанатомической стадии рака, сумме Глисона, характеру хирургического края, объему удаленной опухоли, лимфоваскулярной и периневральной инвазии. Общепризнанным фактором прогноза рецидива также является предоперационный уровень ПСА в сочетании со степенью распространенности рака.
Уровень простатспецифического антигена
Исследования C.R. Pound в 1999 году показали, что все без исключения случаи рецидива рака простаты сопровождаются повышением уровня простатического специфического антигена (ПСА) — протеина, вырабатываемого клетками предстательной железы. В течение 2-3 недель сразу после успешного проведения радикальной простатэктомии у подавляющего большинства пациентов уровень ПСА снижается до пороговых значений.
Любой рост уровня антигена и его отличная от нуля величина могут быть индикатором локального или отдаленного рецидива рака. Поэтому оценку уровня рекомендуется проводить через 3 и 6 месяцев после операции, затем в течение первых трех лет после РПЭ — через каждые полгода, в дальнейшем — 1 раз год.
Однако если после удаления опухоли остался позитивный хирургический край, уровень ПСА также может незначительно повышаться, при этом другие клинические признаки опухолевого процесса отсутствуют.
На сегодняшний день пороговым значением неблагоприятного прогноза, которое может свидетельствовать о наступлении рецидива рака простаты после радикальной простатэктомии, считается повышение ПСА до 0,2 нг/мл и более в двух последовательных измерениях. При этом вероятность прогрессирования болезни увеличивается, если скорость роста уровня антигена превышает в год 0,75 нг/мл, а удвоение ПСА наступает за срок менее 10 месяцев. При этом также принимают во внимание плотность ПСА — отношение дооперационного уровня антигена к объему удаленной простаты.
Сумма Глисона
Злокачественные опухоли простаты неоднородны. Для оценки структурной дифференцировки злокачественного образования используется сумма Глисона. Она определяется в результате сложения приведенных к пятибалльной шкале результатов гистологического исследования двух участков пораженной железы и позволяет оценить степень прогрессирования опухоли. Минимальный риск развития рецидива у пациентов с локализованной формой рака при показателе Глисона 6, максимальный — при значении от 8 до 10.
Характер хирургического края
При «чистых» краях резекции прогноз развития рецидива минимален, он составляет не более 16%. В то время как при позитивном хирургическом крае — 26%. Уменьшить риск образования позитивного хирургического края позволяет радикальная робот-ассистированная простатэктомия Да Винчи. Система роботической хирургии предоставляет хирургу 3D-изображение и 20-кратное увеличение оперируемой области, что позволяет полностью удалить пораженные ткани.
Совокупность вышеперечисленных факторов, а также объем удаленной опухоли более 4 куб. см, лимфоваскулярная и периневральная инвазия и стадия рака от Т2а и выше увеличивают риск возникновения местного рецидива рака простаты после радикальной простатэктомии.
Диагностические исследования
При возрастании уровня ПСА после РПЭ для уточнения диагноза на ранних стадиях развития рецидива используют современные методы визуализации.
- Трансректальное УЗИ (при подозрении на локальный рецидив и как метод контроля при проведении биопсии).
- Эндоректальная МРТ малого таза с контрастным усилением (идентифицирует рецидивирующие опухоли при относительно низких значениях ПСА).
- Мультиспиральная компьютерная томография (выявление висцеральных и костных метастазов, оценка состояния лимфоузлов).
Проведение компьютерной и магнитно-резонансной томографии рекомендуется пациентам с повышенным уровнем сывороточного ПСА, а также при жалобах на боли в костях (независимо от уровня ПСА).
Методы лечения рецидива
Локализованная форма
Пациентам с высоким риском рецидива может быть рекомендовано проведение адъювантной лучевой терапии сразу после операции. Облучению подвергают ложе удаленной предстательной железы и регионарные лимфатические узлы. Полный курс лечения длится около 7 недель, сессии облучения — ежедневно.
Метастатический рецидив
На стадии рака T3a-bN0/1M0 после РПЭ при низкой распространенности процесса для предотвращения рецидива рекомендовано применение лучевой терапии в комбинации с курсом андрогенной депривации. Пациентам с тяжелыми сопутствующими заболеваниями может быть назначена гормональная терапия или комбинация гормональной и химиотерапии.
Выбор метода лечения для каждого пациента определяется индивидуально в зависимости от стадии заболевания, группы риска, размера опухоли, значений биомаркеров.
Источник
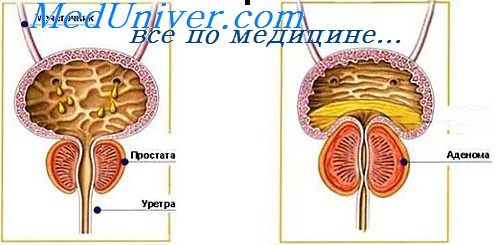
Рецидив аденомы предстательной железы. Гормональный фон при аденоме простатыРезультаты наших наблюдений и данные литературы позволяют прийти к заключению, что истинный рецидив аденомы предстательной железы есть, по-видимому, следствие роста субуретральных (препростатических) железок — остатков заднего отдела мочеиспускательного канала, неудаленных при операции. Обращает на себя внимание факт сочетания опухолей в других органах и системах и предстательной железе. Сочетания аденомы предстательной железы с опухолями мочеполовой системы мы наблюдали у 54 больных в возрасте от 49 до 83 лет. Аденома предстательной железы сочеталась с папилломой мочевого пузыря у 7 больных, с плоскоклеточным раком мочевого пузыря — у 5, с сосочковым раком мочевого пузыря — у 6, с гипернефроидным раком правой почки — у 10, левой — у 7, с остроконечными кондиломами полового члена—у 6, с лейкоплакией — у 4 и раком полового члена — у 9 больных. И. Викторов и соавторы (1978) из 890 больных, оперированных по поводу аденомы предстательной железы, у 27 (3,03%) при гистологическом исследовании выявили рак. У 19 из них он сочетался с аденомой. Патоморфологические исследования позволили прийти к выводу, что рак не был распознан до операции из-за малых размеров опухоли и ее центрального расположения. Типичное злокачественное перерождение аденомы предстательной железы мы наблюдали в 11,7% случаев и пришли к заключению, что на основании исследования одного кусочка, взятого из какого-либо отдела железы, не всегда удается определить истинное морфологическое состояние удаленного новообразования. Одна половина железы может быть совершенно интактна, а во второй могут быть очаги метаплазии покровного эпителия и многослойный плоский эпителий с последующим переходом в истинный рак. Таким образом, метаплазия в данном случае является как бы переходным моментом от доброкачественной аденомы к развитию участков истинного рака. Итак, гистологическая структура, способность давать рецидивы после аденомэктомии, способность к. злокачественной трансформации, наличие типичных фибро-, фибро-миоматозных образований в разросшейся железистой ткани и сочетание с другими доброкачественными и злокачественными опухолями позволяют аденому предстательной железы рассматривать как типичную бластому.
Данные о биосинтезе андрогенов у больных с гиперпластическими процессами предстательной железы весьма ограничены, так как для получения их необходим сбор оттекающей от яичек крови. Moon и Flocks (1970), Farnworth (1971), Harder и соавторы (1976), Hammond и соавторы (1978), Ortega и соавторы (1979) наблюдали уменьшение уровня тестостерона у мужчин с аденомой предстательной железы. Это подтверждает представление о патогенетическом значении, дефицита андрогенов в развитии доброкачественной опухоли предстательной железы. Однако другие авторы не обнаружили изменений в концентрации плазменного тестостерона, ДГТ, андростендиона и андростендиола в периферической крови больных, с аденомой предстательной железы (Becker и соавт., 1973; Bayard и соавт., 1974; Griffits, 1974; Skoldefors и соавт., 1978; Bartsch и соавт., 1979). Некоторые авторы отметили даже повышение уровнд тестостерона (Zgliczynski и- Baranowska, 1979; Baranowska и Zgliczynski, 1979). По данным Orestano и Altwein (1976), из 23 обследованных пациентов у 15 содержание плазменного тестостерона было в норме, у 3 — понижено, у 5 — повышено. Таким образом, сделать окончательное заключение об изменении уровня циркулирующего тестостерона у больных аденомой невозможно. При анализе причин выявленных расхождений учитывали различные факторы, в частности возраст больных. У мужчин 60—70 лет (Vermeulen и De Sy, 1976; Hammond и соавт., 1977) различий в содержании тестостерона по сравнению с контрольной группой не выявлено, однако у мужчин от 70 до 80 лет оно было повышено. Аналогичную зависимость для андростандиола подметили Bartsh и соавторы (1979). Важно проанализировать соотношения различных андрогенов у больных аденомой предстательной железы, поскольку биологическое действие их на этот орган неоднозначно. Horton и соавторы (1975), Hammond и соавторы (1977) сообщили, что у указанного контингента больных преобладает ДГТ. В плазме больных аденомой 60—90 лет содержание тестостерона было пониженным, а уровень ДГТ повышенным по сравнению с их уровнем в крови мужчин 20—29 лет. По-видимому, увеличение уровня ДГТ в крови характерно для этого заболевания и не зависит от возраста больного, поскольку в наблюдениях Chisholm и Chanadian (1976), Vermeulen и De Sy (1976), Hammond и соавторы (1978) выявлено значительное увеличение концентрации плазменного ДГТ у мужчин 50—80 лет с гиперплазией предстательной железы, чего не наблюдалось у здоровых мужчин этого возраста. – Также рекомендуем “Обмен тестостерона при аденоме простаты. Андрогены при аденоме предстательной железы” Оглавление темы “Аденома предстательной железы”: |
Источник
