Иммунологические аспекты при хроническом простатите

Симченко Н.И.
Могилевская областная больница
Введение.
Хронический простатит является самым распространенным урологическим заболеванием у мужчин моложе 50 лет и третьим по частоте урологическим диагнозом у мужчин старше 50 лет (после доброкачественной гиперплазии и рака простаты), составляя 8% амбулаторных визитов к урологу[1]. С возрастом частота заболевания увеличивается и достигает 30-73% . Влияние этого заболевания на качество жизни сопоставимо с инфарктом миокарда, стенокардией, болезнью Крона, что обуславливает также и значительные психологические и социальные проблемы у больных простатитом мужчин трудоспособного возраста.[3] При определении относительной частоты выявления разных форм хронического простатита большинством специалистов было показано, что на долю хронического бактериального простатита (ХБП) приходится 5-15 % случаев заболевания, в то время как на долю воспалительного синдрома хронической тазовой боли приходится 60-65% случаев, а около 30 % составляют больные с невоспалительным синдромом хронической тазовой боли.[2] С позиции патологической анатомии, простатит определяется повышением количества воспалительных клеток в паренхиме предстательной железы. Частым признаком воспаления является лимфоцитарная инфильтрация в строме предстательной железы[5] . Для пациентов с хроническим бактериальным простатитом характерны патологические изменения иммунологических показателей, свидетельствующие о депрессии иммунной системы (снижение уровней ИФНα и ИФНγ, sIgA, функциональной активности нейтрофилов, повышение концентраций IgA, IgG, IgM).[4]
Инфекция простаты может быть следствием бактериальной колонизации мочеиспускательного канала.[7] Бактериальная колонизация может также вызвать персистенцию бактерий в простате. Отличительной чертой этого состояния является персистенция бактерий внутри простаты, несмотря на лечение антибиотиками, что связано с хроническим воспалением простаты и склонностью к обострению инфекции мочевыводящего тракта тем же самым патогеном.[8] Диссинергия при мочеиспускании может привести к анатомически чрезмерной стимуляции нервных волокон, иннервирующей область промежности и таза, с последующим развитием хронического невропатического болевого состояния. Или, такое высокое давление и дисфункциональное мочеиспускание могут вызвать интрапростатический рефлюкс мочи в протоки у части больных. [11]
Рефлюкс мочи и, возможно, бактерий в протоки простаты является одним из самых важных механизмов патогенеза хронического бактериального и абактериального воспаления при простатите. По своей анатомии система дренажа протоков периферической зоны более чувствительна к интрапростатическому рефлюксу в протоки, чем другие области простаты[9]. Если патогенные бактерии попадают в предстательную железу с помощью рефлюкса, они могут существовать в виде защищенных агрегатов внутри камней простаты. Большое количество культур патогенов, покрывающих камни в простате, было показано Eykyn (1974). Этот способ колонизации бактерий, который заключается в образовании защищающих бактериальных агрегатов или биопленок, связанных с камнями простаты, может приводить к развитию неподдающегося лечению ХБП и к последующей рецидивирующей инфекции мочевых путей.
При абактериальном простатите бактериальное воспаление простаты может быть вторичным иммунологически опосредованным воспалением, вызванным каким-нибудь неизвестным антигеном, или, возможно, воспаление может быть связанно с аутоиммунным процессом. Уровни антител IgA(сывороточный IgA является фракцией гамма-глобулинов и составляет 10-15 % от общего количества всех растворимых иммуноглобулинов. IgA обнаруживаются преимущественно в секретах) и IgM (неспецифичных к микроорганизмам) повышаются[6], подобные антитела, так же как фибриноген и С3 компонент комплемента[12] были обнаружены при биопсии простаты у больных с хроническим простатитом. Каким бы ни было начальное событие, оказывается, что иммунологический каскад играет важную роль при развитии простатита[15].
При хроническом бактериальном простатите характерны патологические изменения иммунологических показателей, свидетельствующие о депрессии иммунной системы (снижение уровней ИФНα и ИФНγ, sIgA, функциональной активности нейтрофилов, повышение концентраций IgA, IgG, IgM).[14] В исследованиях с использованием иммунофлюоресцентных методов диагностики было установлено отложение в тканях предстательной железы больных хроническим уретрогенным простатитом IgA и IgM, фибриногена, С. компонента комплемента [13]. Кроме того, в тканях предстательной железы как при хроническом бактериальном, так и при абактериальном простатите была выявлена экспрессия HLA DR, большого количества Т-лимфоцитов с преобладанием субпопуляций CD8+ над CD4+, повышенного количества антигенпрезентирующих клеток и тканевых макрофагов, отсутствие В-лимфоцитов [10]. Эти данные свидетельствуют о том, что воспалительная реакция при хроническом простатите носит характер иммунной клеточной реакции,
Материалы и методы
Были сформированы 2 группы пациентов – 1- с иммунокоррекцией на фоне стандартного комплекса лечения и 2 – без иммунокоррекции.
Продолжительность исследования составила 4 месяца, в течение которых было проведено 3 визита. На скрининговом визите (0) оценивалось соответствие пациента критериям включения/исключения. Далее проводился опрос и клинический осмотр. Симптомы хронического простатита оценивались по шкале Национального института здоровья США NIH-CPSI.
Были проведены клинические анализы крови и мочи, бактериологическое и микроскопическое исследование секрета предстательной железы, а также трансректальное ультразвуковое исследование. В течение 1 визита уточнялось соответствие пациента критериям включения/исключения c учетом данных лабораторных исследований. Образец венозной крови использовали для иммунологического анализа, уровня иммуноглобулинов IgA, G и М
Результаты и их обсуждение
В исследование были включены 40 пациентов в возрасте от 20 до 54 лет (средний возраст 38,8±9,1 лет). Подавляющему большинству исследуемых (17 человек – 42,5%) было на момент начала исследования от 40 до 49 лет.
Выраженность симптомов хронического простатита оценивалась по шкале NIH-CPSI. На скрининговом визите суммарный балл в среднем составил 26 баллов.
В ходе лечения уровень выраженности симптомов хронического бактериального простатита снизился в обеих группах. При этом в первой группе суммарный балл по шкале NIH-CPSI на 2 и 3 визите был статистически значимо ниже, чем в контрольной (p<0,05).
Бактериологическое исследование секрета простаты, выполненное после окончания терапии, выявило эрадикацию патогенных микроорганизмов у 60-70% пациентов с простатитом в обеих группах. При этом в экспериментальной группе(c иммунокоррекцией) наблюдалась более полная элиминация инфекционного агента.
После лечения в секрете предстательной железы у 50% пациентов экспериментальной группы отмечено снижение количества лейкоцитов до не более 10 в поле зрения, при этом в контрольной группе этот результат был достигнут только у 15%. Это говорит о том, что в экспериментальной группе снижение интенсивности воспалительного процесса было более выражено.
Уровень sIgA в секрете предстательной железы определяли до и после лечения (n=6).
До лечения концентрация IgA была значительно ниже нормы. В обеих группах после лечения уровень секреторного IgA повысился, причем в первой группе практически в 2 раза, во второй – только в 1,5 раза. Это свидетельствует об усилении местных защитных реакций, которое было более выражено в экспериментальной группе
Иммунологические параметры
Исследовался уровень Т- и В-лимфоцитов в % и абсолютных цифрах, уровень Т-х и Т-с, нулевые лимфоциты, ИН(индекс нагрузки) и иммуноглобулины А, М,G.
Статистически значимых изменений в процентном содержании Т- и В-лимфоцитов не выявлено, однако при изучении абсолютных показателей до лечения выявлено снижение В-л у 47% пациентов, Т-л – у 23 %, сочетание – у 23,5%.
ИН был повышен у 64,7%, хотя Т-х были выше нормы только у 5 % пациентов, а Т-с ниже нормы тоже только у 5%. Т.е. у большинства больных хроническим простатитом отмечается выраженный дисбаланс в клеточном звене иммунитета.
Гуморальный иммунитет
До начала лечения уровень IG A был повышен у 11% пациентов, что свидетельствует о аутоиммуном компоненте заболевания. Снижение содержания IgA свидетельствует о недостаточности гуморального и местного иммунитета. Увеличение концентрации может свидетельствовать об острых и хронических инфекционных процессах . Низкий уровень содержания Ig M отмечен у 12,7% пациентов, из них у 2 (5%) полное отсутствие Ig M. (IgM – первый иммуноглобулин, отвечающий на внедрение инфекции. Является маркером остроты процесса. Снижение показателя говорит об иммунодефиците)
IgG –основной иммуноглобулин в сыворотке, служит для долговременной защиты от инфекций. Аутоантитела относятся к этому классу. У 12,8% пациентов отмечено повышение уровня IG G, что свидетельствует об аутоиммуном компоненте воспаления.
Выводы
- Лечение хронического воспалительного процесса в предстательной железе невозможно без иммунокоррекции, но адекватная иммунокоррекция должна проводится только под иммунологическим контролем.
- Для коррекции дисбаланса в клеточном звене рекомендуется использование ликопида 1 мг 1 разсутки в течение 10 дней , с последующим контролем иммунограммы (повышает уровень В-л и Т-с)
- Для снятия аутоиммной активности рекомендуется использование метронидазола 100,0 вв 1 раз в сутки 7-10 дней и десенсибилизирующей терапии (лоратадин)
- Для коррекции Т-В лимфоцитов –декарис 150 мг 1 раз в сутки 3 дня подряд или 1 раз в неделю 3 недели подряд с контролем иммунограммы через 2 недели после курса.
- При отсутствии IgM мы применяли свечи лаферобион 500 000 ед по 1 свече 2 раза в сутки в течение 10 дней и свечи витапрост-форте по 1 в сутки в течение 20 дней. Восстановление иммуноглобулина происходило в течение 1 месяца и сохранялось на нормальных значениях при контроле через 6 месяцев
- Не рекомендуется длительная (более 7 дней) иммуностимуляция (особенно без контроля иммунограммы). Избыточная иммуностимуляция провоцирует аутоиммный компонент воспаления и воспаление, вызываемое ею может быть причиной роста интрапростатического давления
Литература.
1. Мазо Е.Б., Степенский А.Б., Гамидов С.И., Григорьев М.Э., Кривобородов Г.Г., Белковская М.Н. Фармакотерапия хронических простатитов. РМЖ 2001; т.9 , № 23.
2. Степенский А.Б., Попов С.В., Муфагед М.Л. Диагностика и лечение хронического простатита. Consilium medicum 2003, т.5, № 7: 396-401.
3. Набер К., Бергман Б. и др. Рекомендации Европейской ассоциации урологов по лечению инфекций мочевыводящих путей и инфекций репродуктивной системы у мужчин. Клиническая микробиология и антимикробная химиотерапия 2002; т.4,№ 4: 347-363.
4. McNaughton-Collins M, Stafford RS et al: How common is prostatitis? A national survey of physician visits. J Urol 1998; 159: 1224-1228.
5. Luzzi G. The prostatitis syndromes.Int STD and AIDS 1996; 7:471-478
6. Krieger JN, Egan KJ: Comprehensive evaluation and treatment of 75 men referred to chronic prostatitis clinic. Urology 1991; 38: 11-19.
7. Kohnen PW, Drach GW: Patterns of inflammation in prostatic hyperplasia: A histologic and bacteriologic study. J Urol 1979;121:755-760.
8. Weidner W, Schiefer HG, Krauss H, et al: Chronic prostatitis: A thorough search for etiologically involved microorganisms in 1461 patients. Infection 1991b; 19:119-125.
9. Bergman B: On the relevance of gram-positive bacteria in prostatitis. Infection 1994; 22(Supp l):22.
10. Domingue GJ: Cryptic bacterial infection in chronic prostatitis: Diagnostic and therapeutic implications. Curr Opin Urol 1998;8:45-49.
11. Krieger JN, Riley DE, Roberts MC, Berger RE: Prokaryotic DNA sequences in patients with chronic idiopathic prostatitis. J Clin Microbiol 1996b;34:3120-3128.
12. Zermann DH, Schmidt RA: Neurophysiology of the pelvic floor: Its role in prostate and pelvic pain. Textbook of Prostatitis. Oxford, UK, ISIS Medical Media, 1999, pp 95-105.
13. Workshop Committee of the National Institute of Diabetes and Digestive and Kidney Disease (NIDDK) Chronic Prostatis Workshop. Bethesda. Md., 1995.
14. Meares E. M, Stamey T. A. Invest. Urol 1968; 5; 492.
15. Bjerclund Johansen T.E., Gruneberg R. N., Guibert J. et. al. The Role of Antibiotics in the Treatment of Chronic Prostatitis: A Consensus Statement. Eur. Urol 1998; 34: 457-466.
Источник
Хронический простатит называют «корзиной для клинически неясных состояний». Возможно, именно поэтому 10% урологических больных в России выставляется именно этот диагноз. Хронический простатит является самым распространенным урологическим заболеванием у мужчин моложе 50 лет и третьим по частоте урологическим диагнозом у мужчин старше 50 лет.
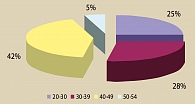
Рисунок 1. Распределение пациентов по возрастным группам (лет)

Рисунок 2. Оценка выраженности симптомов хронического простатита по шкале NIH-CPSI
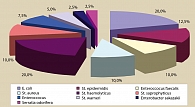
Рисунок 3. Результаты бактериологического исследования СПЖ до лечения

Рисунок 4. Динамика количества лейкоцитов в секрете предстательной железы

Рисунок 5. Динамика количества липоидных телец в секрете предстательной железы

Рисунок 6. Динамика количества макрофагов в секрете предстательной железы у пациентов экспериментальной и контрольной групп
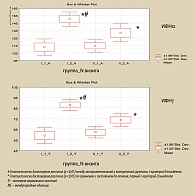
Рисунок 7. Динамика уровня ИФНα и ИФНγ у пациентов экспериментальной и контрольной групп

Рисунок 8. Динамика результатов НСТ-спонтанного теста

Рисунок 9. Динамика результатов НСТ-стимулированного теста

Рисунок 10. Динамика концентрации sIgA в секрете предстательной железы у пациентов экспериментальной и контрольной групп

Рисунок 11. Динамика уровня IgA в крови у пациентов экспериментальной и контрольной групп

Рисунок 12. Динамика уровня IgG в крови у пациентов экспериментальной и контрольной групп

Рисунок 13. Динамика уровня IgM в крови у пациентов экспериментальной и контрольной групп

Рисунок 14. Клиническая оценка эффективности терапии

Рисунок 15. Бактериологическая оценка эффективности терапии

Рисунок 16. Комплексная оценка эффективности терапии
Базисной характеристикой терапии хронического бактериального простатита должна быть комплексность, а именно: она должна включать в себя не только антибактериальную терапию, но и массаж предстательной железы, физиотерапию, иммуномодулирующую терапию, коррекцию образа жизни. В связи с тем, что при простатитах отмечаются нарушения в гуморальном и местном звеньях иммунитета (10-12, 22, 23, 33), в комплексной терапии простатитов огромное значение имеет применение иммуномодуляторов (13, 32, 37), например, по последним литературным данным, предполагается высокая эффективность интерферонов (7, 16, 17, 24, 29).
Известны следующие эффекты интерферонов: антипролиферативный, противоопухолевый, противовирусный, иммуномодулирующий. Иммуномодулирующий эффект обусловлен способностью интерферонов модулировать взаимодействия иммунокомпетентных клеток. Этот механизм реализуется с помощью регуляции экспрессии белков HLA и чувствительности к цитокинам. Интерфероны способны стимулировать активность натуральных киллеров, макрофагов, простагландиновой и кортикостероидной систем, а также подавлять активность В-лимфоцитов. В результате происходит усиление фагоцитарных и цитотоксических реакций в зоне воспалительного очага, что ведет к эффективной элиминации инфекционного агента (2, 5, 21, 30, 38).
C учетом вышесказанного нами проведено двойное слепое рандомизированное плацебо‑контролируемое клиническое исследование 40 пациентов с подтвержденным хроническим бактериальным простатитом, целью исследования являлось изучение клинико-иммунологических аспектов хронического бактериального простатита на фоне проведения иммуномодулирующей терапии. Мы поставили перед собой следующие задачи: во-первых, изучить клинико-иммунологические показатели у пациентов с хроническим бактериальным простатитом, во-вторых, изучить эффективность и безопасность применения интерферона-альфа (ИФНα) при хроническом бактериальном простатите, а именно, определить влияние препарата Генферон (суппозитории с рекомбинантным ИФНα, таурином и анестезином, ЗАО «БИОКАД», Россия) на выраженность воспалительных явлений в предстательной железе и клинических симптомов хронического простатита, изучить влияние препарата ИФН-α на состояние иммунной системы пациента, а также выяснить частоту и выраженность нежелательных явлений при его применении.
Материалы и методы
Продолжительность исследования составила 4 месяца, в течение которых было проведено 3 визита. На скрининговом визите (0) оценивалось соответствие пациента критериям включения/исключения и подписывалось информированное согласие. Далее проводился опрос и клинический осмотр. Симптомы хронического простатита оценивались по шкале Национального института здоровья США NIH-CPSI. Были проведены клинические анализы крови и мочи, ПЦР-диагностика вируса простого герпеса I и II типов (ВПГ1+2), цитомегаловируса (ЦМВ) и Chlamydia trachomatis в соскобе эпителия уретры, бактериологическое и микроскопическое исследование секрета предстательной железы, а также трансректальное ультразвуковое исследование. В течение одного визита уточнялось соответствие пациента критериям включения/исключения c учетом данных лабораторных исследований. Образец венозной крови использовали для иммунологического анализа, включающего определение уровня интерферонов альфа и гамма, функциональной активности нейтрофилов, уровня иммуноглобулинов IgA, G и М. По результатам рандомизации (выбор одной из двух серий суппозиториев методом случайных чисел) включенным в исследование пациентам назначались суппозитории, представляющие собой препарат Генферон или плацебо. Введение препарата осуществлялось ректально 2 раза в сутки в течение 10 дней. Параллельно назначался препарат стандартной терапии – ципрофлоксацин в таблетках по 500 мг 2 раза в сутки в течение 10 дней. В течение второго визита, на следующий день после окончания курса лечения, проводились те же обследования и анализы, кроме того регистрировались нежелательные явления, произошедшие во время приема исследуемого препарата. Через 3 месяца после завершения терапии устанавливали с пациентом телефонный контакт, во время которого регистрировали выраженность симптомов хронического простатита по шкале NIH-CPSI. Данные исследования анализировали по критериям безопасности и эффективности при помощи методов описательной, параметрической и непараметрической статистики.
Результаты и их обсуждение
В исследование были включены 40 пациентов в возрасте от 20 до 54 лет (средний возраст 38,8 ± 9,1 года). При анализе рисунка 1 видно, что подавляющему большинству исследуемых (17 человек – 42,5%) было на момент начала исследования от 40 до 49 лет.
Выраженность симптомов хронического простатита оценивалась по шкале NIH-CPSI (рисунок 2). На скрининговом визите суммарный балл в среднем составил 26 баллов. В ходе лечения уровень выраженности симптомов хронического бактериального простатита снизился в обеих группах. При этом в первой группе суммарный балл по шкале NIH-CPSI на 2-м и 3-м визите был статистически значимо ниже, чем в контрольной (p
По результатам бактериологического исследования СПЖ до лечения у большинства пациентов были выделены E. coli и St. haemolyticus (рисунок 3).
Бактериологическое исследование секрета простаты, выполненное после окончания терапии, выявило эрадикацию патогенных микроорганизмов у 60-70% пациентов с простатитом в обеих группах. При этом в экспериментальной группе наблюдалась более полная элиминация инфекционного агента (рисунок 4).
После лечения в секрете предстательной железы у 50% пациентов экспериментальной группы отмечено снижение количества лейкоцитов до не более 10 в поле зрения, при этом в контрольной группе этот результат был достигнут только у 15%. Это говорит о том, что в экспериментальной группе снижение интенсивности воспалительного процесса было более выражено (рисунок 4).
Содержание липоидных телец является показателем секреторной функции предстательной железы. В норме их должно быть больше 100 в поле зрения. Увеличение количества липоидных телец свидетельствует о благоприятной тенденции к восстановлению нормальной секреторной функции предстательной железы (рисунок 5).
При анализе динамики количества макрофагов в секрете предстательной железы у пациентов экспериментальной и контрольной групп следует отметить, что количество макрофагов в первой группе значительно увеличилось. Данный эффект может быть трактован как увеличение активности фагоцитарных клеток и как следствие усиление иммунной защиты организма (рисунок 6).
При анализе концентраций интерферонов до и после лечения заметно, что до лечения у больных хроническим простатитом уровни ИФНα и ИФНγ значительно ниже нормы, которая показана штриховкой (рисунок 7).
После проведенного лечения наблюдалось повышение уровней ИФНα и ИФНγ, при этом в основной группе оно было значительно более выражено, нежели в контрольной. Следует обратить внимание, что в экспериментальной группе уровень ИФНα после лечения соответствовал норме.
Функциональную активность нейтрофилов определяли по реакции восстановления нитросинего тетразолия до и после лечения. Спонтанный НСТ-тест с интактными нейтрофильными гранулоцитами отражает степень функционального раздражения фагоцитирующих клеток in vivo, являясь косвенным показателем состояния иммунологического гомеостаза (рисунок 8). По данным проведенного до лечения теста, была отмечена значительная декомпенсация функции фагоцитарных клеток. В первой группе после лечения отмечено значительное усиление функциональной активности нейтрофилов до нормы. Во второй группе во время лечения статистически значимых изменений данного параметра отмечено не было.
Аналогичные результаты получены при анализе параметров НСТ-стимулированного теста, который характеризует потенциальную активность нейтрофилов и рассматривается как биохимический критерий их готовности к завершению фагоцитоза (рисунок 9). Снижение этого показателя позволяет диагностировать блокаду выработки кислородозависимых бактерицидных факторов. После лечения в первой группе отмечено значительное усиление функциональной активности нейтрофилов. Во второй группе, напротив, отмечено ее снижение.
Уровень sIgA в секрете предстательной железы определяли до и после лечения. Как показано на рисунке 10, до лечения концентрация sIgA была значительно ниже нормы. В обеих группах после лечения уровень секреторного IgA сильно повысился, причем в первой группе практически в 2 раза, во второй – только в 1,5 раза. Это свидетельствует об усилении местных защитных реакций, которое было более выражено в экспериментальной группе.
Концентрации иммуноглобулинов также определяли также в крови пациентов до и после лечения. До лечения у всех больных уровни иммуноглобулинов были значительно повышены. После проведенного лечения их концентрации снизились, при этом в большей степени – в экспериментальной группе. Это говорит о выраженном положительном влиянии интерферонотерапии на показатели гуморального иммунитета, а также об уменьшении интенсивности воспалительного процесса (рисунки 11-13).
За все время исследования аллергических реакций и других побочных эффектов применявшихся лекарственных препаратов зарегистрировано не было. Также не было выявлено отклонений в клинических анализах крови и мочи, а также в результатах трансректального ультразвукового исследования, что говорит о безопасности препарата.
Оценка эффективности терапии
В работе использовались следующие критерии эффективности терапии: снижение показателя на 50% и более расценивалось как выраженный эффект, от 25 до 50% – как хороший эффект, уменьшение показателя менее чем на 25% – как удовлетворительный эффект, а отсутствие динамики или ухудшение состояния пациента – как неудовлетворительный эффект.
Прежде всего, клиническая эффективность оценивалась по выраженности симптомов ХП. Из данных, представленных на рисунке 14, следует, что в экспериментальной группе у 70% пациентов наблюдался выраженный или хороший эффект, в то время как в группе контроля они были отмечены лишь у 30% пациентов.
Результаты бактериологического исследования свидетельствуют о том, что в экспериментальной группе наблюдалась более полная элиминация инфекционного агента по сравнению с контрольной группой (рисунок 15).
Анализ совокупных данных позволяет сделать вывод о том, что выраженный и хороший эффект отмечался в экспериментальной группе в 75% случаев, что больше аналогичного показателя в контрольной группе (60%) (рисунок 16).
Критерий χ2 (хи-квадрат) применяется для сравнения распределений объектов двух совокупностей на основе измерений по шкале наименований в двух независимых выборках.
В ходе настоящего исследования выяснено, что для пациентов с хроническим бактериальным простатитом характерны патологические изменения иммунологических показателей, свидетельствующие о депрессии иммунной системы (снижение уровней ИФНα и ИФНγ, sIgA, функциональной активности нейтрофилов, повышение концентраций IgA, IgG, IgM).
Таким образом, в составе комплексной терапии хронического бактериального простатита применение иммуномодулирующих препаратов оправдано и необходимо. В результате проведенного исследования показано, что препарат Генферон эффективен и безопасен при хроническом бактериальном простатите. При его применении снижается выраженность клинических симптомов хронического бактериального простатита, уменьшается выраженность воспалительных явлений в предстательной железе, стимулируется иммунная система пациента, что проявляется нормализацией иммунологических показателей.
В дальнейшем следует более подробно проанализировать изменения иммунного статуса пациентов с хроническим бактериальным простатитом, определить возможные механизмы действия интерферона-α и рассмотреть вероятность вирус-ассоциированной инфекции в предстательной железе у данных больных. Возможно, именно этим обусловлена высокая эффективность интерферонотерапии. У включенных в исследование больных была проведена ПЦР-диагностика вируса простого герпеса I и II типов (ВПГ1+2) и цитомегаловируса (ЦМВ) в соскобе эпителия уретры. Однако помимо этих вирусов вирусный простатит предположительно могут вызывать также вирус папилломы человека и вирус опоясывающего лишая, хотя данных в литературе по этому поводу чрезвычайно мало (1, 4, 6, 9, 15, 27, 28, 34). В клинической практике диагноз вирусного простатита ставится урологами редко. Причина, по-видимому, заключается в том, что вирусологические методы диагностики не входят в стандарт обследования больных с хроническим простатитом. В силу стереотипов мышления врача пациентам традиционно проводится обследование на половые инфекции невирусной природы.
Все это позволяет представить многообразие возможных направлений в лечении хронического простатита и подтверждает необходимость разработки индивидуальных терапевтических программ для каждого больного.
Источник
